成功案例
相关资讯
- 2024-11-02实验室设计标准是什么?
- 2024-09-15生物安全实验室装修与设
- 2024-09-15化学实验室设计方案,一
- 2024-09-15实验室通风设计规范,详
- 2024-09-15实验室防火设计规范,详
- 2024-09-15环境实验室装修设计,一
- 2024-09-15实验室设计建设,哪几个
- 2024-09-05细胞培养实验室设计,哪
- 2024-09-05医学实验室装修设计,注
- 2024-09-05学校实验室设计装修,一
- 2024-09-05细胞实验室装修设计,需
- 2024-09-05dna实验室设计规划,核心
- 2024-09-05无菌实验室设计要求,必
- 2024-09-05化学分析实验室设计,常
- 2024-09-05生物安全实验室建筑设计

咨询热线:
027-82289886
固话:027-82289886
邮箱:46569193@qq.com
地址:武汉市江岸区建二七工业园6栋2楼205室-
产品详情
-
联系我们
无菌医疗器械洁净厂房部分设置要求
武汉得创净化介绍无菌医疗器械洁净厂房中洁净室(区)级别设置原则,以及医疗器械厂房对工作、生产及厂区的环境要求,总体布局的合理性以及洁净生产区生产过程和静压差等要求。
对工作环境的要求
若有可能对产品质量产生不利影响,应对工作环境条件做出定量或定性的规定
包括从原材料的购进(从提货或运输时)开始;到储存、生产加工过程、监视与测量,以及成品的贮存、运输等,直到将产品交付给客户为止。
制定环境条件控制程序文件或作业指导书对环境条件的监视和控制
如果环境条件控制是个特殊过程还应对这个过程进行确认。
厂址选择时应考虑
所在地周围的自然环境和卫生条件良好,至少没有空气或水的污染源,宜远离交通干道、货场等。
厂区的环境要求
厂区的地面、道路应平整不易起尘。宜通过绿化等减少露土面积或有控制扬尘的措施。垃圾、闲置物品等不应露天存放等,总之厂区的环境不应对无菌医疗器械的生产造成污染。

厂区的总体布局合理性
不得对无菌医疗器械的生产区,特别是洁净区有不良影响;人流、物流宜分开。
对新建、扩建的无菌医疗器械生产企业,建议由有医药工业洁净厂房设计资质的单位设计。
洁净生产区
确定在洁净室(区)内生产的过程
分析、识别并确定在洁净室(区)内进行生产的过程,并在相关技术或工艺文件中作出标识。
洁净室(区)的洁净度级别要符合“设置原则”要求。
“设置原则”未能覆盖的或不是单一用途的产品,其环境洁净度级别往产品相似、用途相同或相近上靠,遵循宜高不宜低的原则,就低必须验证。
洁净室(区)静压差要求
不同级别洁净室(区)之间≥5Pa,洁净室(区)与室外≥10Pa
应有压差指示装置。
相同洁净室(区)间压差梯度合理:要求相对高的压差高一些,如果两个过程可能会有一定影响,怕受影响的高一些。
洁净室(区)洁净度级别设置原则
1、采用使污染降至最低限的生产技术,以保证医疗器械不受污染或能有效排除污染。
倡导技术进步,建议用先进的生产技术。
先进的生产工艺、设备、工装和设施等。
在产品形成过程中尽量减少人为因素,最大程度地使产品不暴露在操作环境中,尽可能避免人与产品的直接接触。
2、植入和介入到血管内及需要在万级下的局部百级洁净区内进行后续加工(如灌装封等)的器械,不清洗零部件的加工,末道清洗、组装、初包装及其封口,不低于10000级。
植入到血路或心脏内的器械,如:血管支架、心脏瓣膜、人工血管、起博电极、人工动静脉瘘管、血管移植物、体内药物释放导管和心室辅助装置等。
介入到血路内的器械,如:各种血管内导管(如中心静脉导管)、支架输送系统等。
3、植入到人体组织、与血液、骨腔或非自然腔道直接或间接接触器械,(不清洗)零部件的加工、末道清洗、组 装、初包装及其封口等,不低于100000级。
植入到人体组织的器械,如:如起博器、药物给入器械、神经肌肉传感器和刺激器、人工肌腱、乳房植入物、人工喉、骨膜下植入物和结扎夹等。
与血液直接接触的器械,如:血浆分离器、血液过虑器等。
与血路上某一点接触,作为管路向血管系统输入的器械,其特点是间接地通过药液或血液与人体血路接触,如:一次性使用输液器、一次性使用输血器、一次性使用静脉输液针、延长器、转移器等。
主要与骨接触的器械,如:矫形钉、矫形板、人工关节、骨假体、人工骨、骨水泥和骨内器械等。
4、与人体损伤表面和粘膜接触器械,(不清洗)零部件的加工、末道精洗、组装、初包装及其封口,不低于300000级。
与损伤表面(伤口或其他损伤体表)接触器械,如:溃疡、烧伤、肉芽组织敷料或治疗器械、“创可贴”等。
与粘膜或自然腔道接触器械,如:无菌导尿管、无菌气管插管等,其特点是不经穿刺或切开术进入体内的器械。
5、初包装材料生产环境的要求
与无菌医疗器械的使用表面直接接触、不清洗即使用的初包装材料,宜遵循与产品生产环境的洁净度级别相同的原则,使初包装材料的质量满足所包装无菌医疗器械的要求。
如血管内导管、人工乳房、导尿管等的初包装材料。若初包装材料不与无菌医疗器械使用表面直接接触,不低于300000级。
如一次性使用输液器、一次性使用输血器、一次性使用无菌注射器等的初包装材料。
6、对于有要求或无菌加工灌装封,在10000级下的局部100级洁净区内。
如血管支架的压握、涂药;
血袋生产中抗凝剂、保养液的灌装封;
液体产品的无菌制备和灌装;
以及不能在其容器内进行最终灭菌的固体产品的无菌处理、传输和包装等。
7、洁净工作服清洗、干燥和穿洁净工作服室、专用工位器具的末道清洗与消毒的区域的空气洁净度级别可低于生产区一个级别。
无菌工作服的清洗可在100000级洁净区内,但灭菌后的整理、贮存应在10000级洁净室(区)内。
洁净工作服的清洗、整理最低为300000级洁净区。
医药卫生无尘车间的基本特征:是必须以尘粒和微生物为环境控制对象。
净化车间洁净工程为生产和工作人员提供了一个严格的无菌生产环境,不仅消除了微生物、细菌等污染物,而且提高了产品质量和安全性。每个环节流程都要控制到位,不然再好的生产工艺和管理也不能完全保证产品的质量。
医疗卫生企业要求GMP的目标是确保建立科学的、严格的无菌药品生产环境、工艺、运行和管理体系,最大限度地消除所有可能的、潜在的生物活性、灰尘、热原污染,生产出高品质的、卫生、安全的药物、医用品产品
医疗器械及药品生产制造大部分在无尘室内。其主要配套设施有:
1,Class1K、10K、100K分产品需求有不同等级无尘室;
2,纯水、排气、压缩空气、废排水等生产配套系统;
医疗器械生产车间的特点
1、生物制药工厂不仅设备费用高、生产工艺复杂、洁净级别和无菌的要求高,而且对生产人员的素质有严格的要求。
2、在生产过程中会出现潜在的生物危害,主要有(感染危险,死菌体或死细胞及成分或代谢对人体和其他生物致毒性、致敏性和其他生物学反应,产品的致毒性、致敏性和其他生物学反应,环境效应。)
医疗器械生产车间净化原理
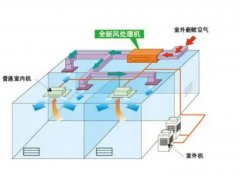
气流→初效空气处理→空调→中效空气处理→风机送风→净化管道→高效送风口→洁净室→带走尘埃(细菌)→ 回风夹道→新风、初效空气处理。
重复以上过程,即可达到净化目的。

医疗器械无尘室技术参数
换气次数:十万级10-15次/小时;万级15-25次/小时;千级50-52次/小时;百级操作台断面风速0.25-0.35m/s。压差:主车间对相邻房间≥5Pa。 温度:冬季>16℃±2℃;夏季 <26℃±2℃;
相对湿度:45-65%(RH);噪声≤65dB(A);新风补充量:总送风量的20%-30%; 照度:≥300Lux。
医疗器械洁净车室结构材料
1.净化室墙、顶板材料一般采用50mm厚的夹芯彩钢板、净化专用的氧化铝型材制造。无尘室门采用净化密闭门,窗采用铝合金玻璃固定窗。
2.净化室地面采用环氧自流平或高级耐磨塑料洁净地板。
3.净化室净化通风管道选用镀锌薄钢板制作,并采用“PEF"阻燃型的保温板做保温。
净化室及无尘室空气中悬浮粒子洁净度等级:
净化室使用场合:
1.净化室适用于半导体工业中的组装试验室、研磨车间;
2.适用于药品医学医院的无菌病房、药剂室手术器械保管室;
3.适用于食品酿造车间;
4.适用于光学仪器的镜片研磨车间、组装车间等。
订购:30万级医疗器械生产车间






































































 32659865
32659865 

